А́томная едини́ца ма́ссы (обозначение а. е. м.), она же дальто́н (обозначение Da) (запрос «Дальтон (единица)»
перенаправляется сюда; см. также другие значения), она же углеродная единица — внесистемная единица массы, применяемая для масс молекул, атомов, атомных ядер и элементарных частиц. Атомная единица массы выражается через массу нуклида углерода 12C и равна 1/12 массы этого нуклида.
Нукли́д (лат. nucleus — «ядро» и др.-греч. είδος — «вид, сорт») — вид атомов, характеризующийся определённым массовым числом, атомным номером и энергетическим состоянием ядер и имеющий время жизни, достаточное для наблюдения.
Общее описание определения следует, что нуклид — это каждый отдельный вид атомов какого-либо химического элемента с ядром, состоящим из строго определённого числа протонов (Z) и нейтронов (N), и которое находится в определённом энергетическом состоянии (основном состоянии или одном из изомерных состояний.
Протон в химии
А́томная едини́ца ма́ссы (обозначение а. е. м.), она же дальто́н (обозначение Da) (запрос «Дальтон (единица)»
перенаправляется сюда; см. также другие значения), она же углеродная единица — внесистемная единица массы, применяемая для масс молекул, атомов, атомных ядер и элементарных частиц. Атомная единица массы выражается через массу нуклида углерода 12C и равна 1/12 массы этого нуклида.
Нукли́д (лат. nucleus — «ядро» и др.-греч. είδος — «вид, сорт») — вид атомов, характеризующийся определённым массовым числом, атомным номером и энергетическим состоянием ядер и имеющий время жизни, достаточное для наблюдения.
Общее описание определения следует, что нуклид — это каждый отдельный вид атомов какого-либо химического элемента с ядром, состоящим из строго определённого числа протонов (Z) и нейтронов (N), и которое находится в определённом энергетическом состоянии (основном состоянии или одном из изомерных состояний.
Протон в химии
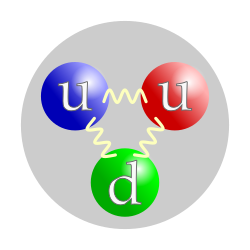
Ядро атома водорода состоит из одного протона. Протон в химическом смысле является ядром атома водорода (точнее, его лёгкого изотопа — протия) без электрона. В физике протон обозначается буквой p (или p+).Химическое обозначение протона (рассматриваемого в качестве положительного иона водорода) — H+, астрофизическое — HII.
Протоны (вместе с нейтронами) являются основными составляющими атомных ядер. Порядковый номер химического элемента в периодической таблице (и, соответственно, все его химические свойства) полностью определяются зарядом ядра его атомов, который, в свою очередь, равен количеству протонов в ядре (протонному числу).
Ядро атома водорода состоит из одного протона. Протон в химическом смысле является ядром атома водорода (точнее, его лёгкого изотопа — протия) без электрона. В физике протон обозначается буквой p (или p+).Химическое обозначение протона (рассматриваемого в качестве положительного иона водорода) — H+, астрофизическое — HII.
Протоны (вместе с нейтронами) являются основными составляющими атомных ядер. Порядковый номер химического элемента в периодической таблице (и, соответственно, все его химические свойства) полностью определяются зарядом ядра его атомов, который, в свою очередь, равен количеству протонов в ядре (протонному числу).
Интересные факты
Число протонов Z представляет собой атомный номер элемента, а сумма A = Z + N — массовое число. Нуклиды, имеющие одинаковый атомный номер (обладающие одинаковым числом протонов), называются изотопами, одинаковое массовое число — изобарами, одинаковое число нейтронов — изотонами. Атомы изотопов являются атомами одного и того же химического элемента. Относительная атомная масса нуклида округлённо равна его массовому числу, только для углерода-12 она по определению точно равна 12.
Число протонов Z представляет собой атомный номер элемента, а сумма A = Z + N — массовое число. Нуклиды, имеющие одинаковый атомный номер (обладающие одинаковым числом протонов), называются изотопами, одинаковое массовое число — изобарами, одинаковое число нейтронов — изотонами. Атомы изотопов являются атомами одного и того же химического элемента. Относительная атомная масса нуклида округлённо равна его массовому числу, только для углерода-12 она по определению точно равна 12.
Z
E
N
, причём индексы Z и N могут опускаться. Распространённым является обозначение «элемент-A» (например, углерод-12, уран-238, U-235). Для нуклидов, представляющих собой метастабильные возбуждённые состояния одного изотопа (изомеры), используют латинскую букву m в верхнем правом или верхнем левом индексе, например 180Tam или 180mTa. Если существует более одного возбуждённого изомерного состояния с данными A и Z, то для них (в порядке возрастания энергии) используют индексы m1, m2 и т.д., либо последовательность букв m, n, p, q,… Некоторые нуклиды имеют традиционные собственные названия (см. список таких названий).
Z
E
N
, причём индексы Z и N могут опускаться. Распространённым является обозначение «элемент-A» (например, углерод-12, уран-238, U-235). Для нуклидов, представляющих собой метастабильные возбуждённые состояния одного изотопа (изомеры), используют латинскую букву m в верхнем правом или верхнем левом индексе, например 180Tam или 180mTa. Если существует более одного возбуждённого изомерного состояния с данными A и Z, то для них (в порядке возрастания энергии) используют индексы m1, m2 и т.д., либо последовательность букв m, n, p, q,… Некоторые нуклиды имеют традиционные собственные названия (см. список таких названий).
Классификация
Нуклиды делятся на стабильные и радиоактивные (радионуклиды, радиоактивные изотопы). Стабильные нуклиды не испытывают спонтанных радиоактивных превращений из основного состояния ядра. Радионуклиды путём радиоактивных превращений переходят в другие нуклиды. В зависимости от типа распада, образуются либо другой нуклид того же самого элемента (при нейтронном или двухнейтронном распаде), либо нуклид другого элемента с тем же массовым числом (распады, изменяющие заряд ядра без вылета нуклонов, т. е. бета-распад, электронный захват,позитронный распад, все виды двойного бета-распада), либо два или несколько новых нуклидов (альфа-распад,протонный распад, кластерный распад, спонтанное деление).
Среди радионуклидов выделяются короткоживущие и долгоживущие. Радионуклиды, существующие на Земле с момента её формирования, часто называют природными долгоживущими, или примордиальными радионуклидами; такие нуклиды имеют период полураспада, превышающий 5·108 лет. Для каждого элемента были искусственно получены радионуклиды; для элементов с атомным номером (т. е. числом протонов), близким к одному из «магических чисел», количество известных нуклидов может доходить до нескольких десятков. Наибольшим количеством известных нуклидов — 46 — обладает ртуть (без учёта изомерных состояний). Некоторые элементы имеют лишь один стабильный нуклид (так называемые моноизотопные элементы, например, золото и кобальт), а максимальным числом стабильных нуклидов — 10 — обладает олово. У многих элементов все нуклиды радиоактивны (все элементы, имеющие атомный номер больше, чем у свинца, а также технеций и прометий). Каждому массовому числу соответствует от 0 до 3 стабильных нуклидов, числу нейтронов — от 0 до 6. Общее число всех известных нуклидов превышает 3100 (без учёта изомеров; на сегодня известно около 1000 нуклидов в основных состояниях, для которых существуют одно или несколько метастабильных возбуждённых состояний с периодом полураспада, превышающим 0,1 мкс).
Для многих нуклидов (в том числе стабильных) предсказан тот или иной вид радиоактивности, в действительности не наблюдающийся из-за чрезвычайно большого периода полураспада. В частности, для любого данного массового числа A возможен только один бета-стабильный нуклид, соответствующий глобальному минимуму энергии в данной изобарной цепочке. Для остальных нуклидов с данным A кинематически разрешён обычный или двойной бета-распад (включая β−, β+ или электронный захват), хотя предсказываемые периоды полураспада могут быть крайне велики. Большинство нуклидов с массовым числом больше 140 могут испытывать альфа-распад, но по той же причине для многих из них этот канал распада не наблюдался. С увеличением чувствительности экспериментов некоторые нуклиды переходят из разряда стабильных в (слабо) радиоактивные (например, была обнаружена слабая альфа-радиоактивность с периодами полураспада >1018 лет у ранее считавшихся стабильными висмута-209, вольфрама-180 и европия-151).
Нуклиды делятся на стабильные и радиоактивные (радионуклиды, радиоактивные изотопы). Стабильные нуклиды не испытывают спонтанных радиоактивных превращений из основного состояния ядра. Радионуклиды путём радиоактивных превращений переходят в другие нуклиды. В зависимости от типа распада, образуются либо другой нуклид того же самого элемента (при нейтронном или двухнейтронном распаде), либо нуклид другого элемента с тем же массовым числом (распады, изменяющие заряд ядра без вылета нуклонов, т. е. бета-распад, электронный захват,позитронный распад, все виды двойного бета-распада), либо два или несколько новых нуклидов (альфа-распад,протонный распад, кластерный распад, спонтанное деление).
Среди радионуклидов выделяются короткоживущие и долгоживущие. Радионуклиды, существующие на Земле с момента её формирования, часто называют природными долгоживущими, или примордиальными радионуклидами; такие нуклиды имеют период полураспада, превышающий 5·108 лет. Для каждого элемента были искусственно получены радионуклиды; для элементов с атомным номером (т. е. числом протонов), близким к одному из «магических чисел», количество известных нуклидов может доходить до нескольких десятков. Наибольшим количеством известных нуклидов — 46 — обладает ртуть (без учёта изомерных состояний). Некоторые элементы имеют лишь один стабильный нуклид (так называемые моноизотопные элементы, например, золото и кобальт), а максимальным числом стабильных нуклидов — 10 — обладает олово. У многих элементов все нуклиды радиоактивны (все элементы, имеющие атомный номер больше, чем у свинца, а также технеций и прометий). Каждому массовому числу соответствует от 0 до 3 стабильных нуклидов, числу нейтронов — от 0 до 6. Общее число всех известных нуклидов превышает 3100 (без учёта изомеров; на сегодня известно около 1000 нуклидов в основных состояниях, для которых существуют одно или несколько метастабильных возбуждённых состояний с периодом полураспада, превышающим 0,1 мкс).
Для многих нуклидов (в том числе стабильных) предсказан тот или иной вид радиоактивности, в действительности не наблюдающийся из-за чрезвычайно большого периода полураспада. В частности, для любого данного массового числа A возможен только один бета-стабильный нуклид, соответствующий глобальному минимуму энергии в данной изобарной цепочке. Для остальных нуклидов с данным A кинематически разрешён обычный или двойной бета-распад (включая β−, β+ или электронный захват), хотя предсказываемые периоды полураспада могут быть крайне велики. Большинство нуклидов с массовым числом больше 140 могут испытывать альфа-распад, но по той же причине для многих из них этот канал распада не наблюдался. С увеличением чувствительности экспериментов некоторые нуклиды переходят из разряда стабильных в (слабо) радиоактивные (например, была обнаружена слабая альфа-радиоактивность с периодами полураспада >1018 лет у ранее считавшихся стабильными висмута-209, вольфрама-180 и европия-151).
История и этимология
Термин «нуклид» (а также «радионуклид») был предложен Трумэном Кохманом (Truman P. Kohman) в 1947 году. Автор термина обсудил его со специалистами по классической филологии (профессорами Гертрудой Смит и Бенедиктом Эйнарсоном), чтобы наиболее точно передать смысл, выражаемый этим словом, т.е. сорт ядер (от латинского корня nucle- — «ядро» и др.-греч. είδος — «вид, сорт», с отбрасыванием лишних гласных на стыке для благозвучия). Определение Кохмэна, данное в его статье, посвящённой новому термину: «Нуклид. Сорт атома, характеризующийся строением его ядра, в частности числом протонов и нейтронов в его ядре».
Рекомендована к применению ИЮПАП в 1960 и ИЮПАК в 1961 годах. Официально рекомендованными являются англоязычные термины atomic mass unit (a.m.u.) и более точный — unified atomic mass unit (u.a.m.u.) (универсальная атомная единица массы, но в русскоязычных научных и технических источниках он употребляется реже).
В 1997 году во 2-м издании справочника терминов ИЮПАК установлено численное значение а. е. м.:
1 а. е. м., выраженная в граммах, численно равна обратному числу Авогадро, то есть 1/NA, выраженному в моль−1. Молярная масса данного элемента, выраженная в граммах на моль, численно совпадает с массой молекулы этого элемента, выраженной в а. е. м.
Поскольку массы элементарных частиц обычно выражаются в электрон-вольтах, важным является переводной коэффициент между эВ и а. е. м.:
- 1 а. е. м. = 0,931 494 028(23) ГэВ/c²;
- 1 ГэВ/c² = 1,073 544 188(27) а. е. м.
Здесь c — скорость света.
Рекомендованное Комитетом по данным для науки и техники значение а. е. м. на 2010 год:
- 1 а. е. м.
 кг.
кг.
Термин «нуклид» (а также «радионуклид») был предложен Трумэном Кохманом (Truman P. Kohman) в 1947 году. Автор термина обсудил его со специалистами по классической филологии (профессорами Гертрудой Смит и Бенедиктом Эйнарсоном), чтобы наиболее точно передать смысл, выражаемый этим словом, т.е. сорт ядер (от латинского корня nucle- — «ядро» и др.-греч. είδος — «вид, сорт», с отбрасыванием лишних гласных на стыке для благозвучия). Определение Кохмэна, данное в его статье, посвящённой новому термину: «Нуклид. Сорт атома, характеризующийся строением его ядра, в частности числом протонов и нейтронов в его ядре».
 кг.
кг.История
Понятие атомной массы ввёл Джон Дальтон в 1803 году, единицей измерения атомной массы сначала служила масса атома водорода (так называемая водородная шкала). В 1818г. Берцелиус опубликовал таблицу атомных масс, отнесённых к атомной массе кислорода, принятой равной 103. Система атомных масс Берцелиуса господствовала до 1860-х годов, когда химики опять приняли водородную шкалу. Но в 1906г. они перешли на кислородную шкалу, по которой за единицу атомной массы принимали 1/16 часть атомной массы кислорода. После открытия изотопов кислорода (16O, 17O, 18O) атомные массы стали указывать по двум шкалам: химической, в основе которой лежала 1/16 часть средней массы атома природного кислорода, и физической с единицей массы, равной 1/16 массы атома нуклида 16O. Использование двух шкал имело ряд недостатков, вследствие чего с 1961 перешли к единой, углеродной шкале.
https://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BE%D0%BC%D0%BD%D0%B0%D1%8F_%D0%B5%D0%B4%D0%B8%D0%BD%D0%B8%D1%86%D0%B0_%D0%BC%D0%B0%D1%81%D1%81%D1%8B
https://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BE%D0%BC%D0%BD%D0%B0%D1%8F_%D0%B5%D0%B4%D0%B8%D0%BD%D0%B8%D1%86%D0%B0_%D0%BC%D0%B0%D1%81%D1%81%D1%8B



Комментариев нет:
Отправить комментарий